Premium Only Content

Cos'è la carne sintetica coltivata in laboratorio? DOCUMENTARIO questa cosa fu discussa dal World Economic Forum di Klaus Schwab nel 2015 in una conferenza dal titolo The Meat Revolution tradotto la rivoluzione della carne...
video originale: https://youtu.be/1lI9AwxKfTY?feature=shared https://en.wikipedia.org/wiki/Cultured_meat https://en.wikipedia.org/wiki/Tissue_engineering
La carne coltivata, nota anche come carne sintetica tra gli altri nomi, è una forma di agricoltura cellulare in cui la carne viene prodotta coltivando cellule animali o umane in vitro. La carne coltivata viene prodotta utilizzando tecniche di ingegneria tissutale sperimentate nella medicina rigenerativa. Jason Matheny ha reso popolare il concetto nei primi anni 2000 dopo essere stato co-autore di un articolo sulla produzione di carne coltivata e aver creato New Harvest, la prima organizzazione senza scopo di lucro al mondo dedicata alla ricerca sulla carne in vitro.La carne coltivata ha il potenziale per affrontare l'impatto ambientale della produzione di carne, il benessere degli animali, la sicurezza alimentare e la salute umana,oltre alla sua potenziale mitigazione dei cambiamenti climatici.
in America è già in vendita ed è legale la carne coltivata come pure in Israele oltre il latte sintetico l'hanno approvato le autorità competenti lì..mica fantascienza..Nel gennaio 2024, il Ministero della Salute israeliano ha concesso l'approvazione normativa per la carne bovina coltivata.. riassunto biolabs e plandemie qui: https://rumble.com/v4929ir-biologia-sintetica-documentario-rai https://rumble.com/v4ax9wl-cos-la-carne-coltivata-in-laboratorio https://rumble.com/v4axfau-la-conferenza-del-world-economic-forumthe-meat-revolution-del-2015-document https://rumble.com/v4asjq6-come-si-produce-la-carne-sintetica-in-laboratorio https://rumble.com/v4awro0-litalia-ha-solo-vietato-la-produzione-in-italia-di-carne-sintetica https://rumble.com/v4atqq9-il-latte-sintetico-cos-e-cosa-cambia-rispetto-alla-carne-sintetica https://rumble.com/v4a1ymi-la-carne-sintetica-fatta-in-laboratorio-utilizzando-la-biologia-sintetica https://rumble.com/v4axieu-allinterno-del-progetto-di-produzione-di-carne-coltivata-in-laboratorio https://rumble.com/v4axyp6-la-carne-coltivata-in-bioreattori-gi-arrivata-da-tempo https://rumble.com/v4axhbi-la-carne-sintetica-allevata-in-laboratorio https://rumble.com/v33yxzn-il-documentario-del-massone-cannibale-pedo-frocio-gregg-wallace https://rumble.com/v3yhuev-il-cannibalismo-rituale-nei-culti-misterici-satanici https://rumble.com/v33yo2n-espondendo-il-sito-human-meat-project-people-for-people-documentario
https://rumble.com/v33ncwo-il-sito-human-meat-project-vende-carne-umana-ai-cannibali-satanici https://rumble.com/v33n8j6-avvertenza-human-farming-project-su-facebook-vende-carne-umana-per-i-cannib https://rumble.com/v482coi-perch-esiste-il-cannibalismocosa-ci-insegna-la-storia-documentario https://rumble.com/v3j62ps-strane-notizie-a-cui-non-crederai https://rumble.com/v3j6lm2-il-trailer-del-film-the-farm-del-2018 https://rumble.com/v3j69i4-il-gioco-di-simulazione-human-farm-in-uscita-nel-2024
The Meat Revolution, una conferenza al World Economic Forum di Mark Post dell'Università di Maastricht sulla carne in vitro (runtime 20:16)
Un video di New Harvest / Xprize che spiega lo sviluppo della carne coltivata e una "bioeconomia post-animale, guidata da proteine coltivate in laboratorio (carne, uova, latte)" (durata 3:09)
Nel 2013, Mark Post ha creato un hamburger a base di tessuto coltivato al di fuori di un animale. Da allora, altri prototipi di carne coltivata hanno attirato l'attenzione dei media: SuperMeat ha aperto un ristorante dalla fattoria alla tavola, chiamato "The Chicken",[14] a Tel Aviv per testare la reazione dei consumatori al suo hamburger "Chicken",[15] mentre la "prima vendita commerciale al mondo di carne coltivata con cellule" si è verificata nel dicembre 2020 al ristorante 1880 di Singapore, dove la carne coltivata prodotta dall'azienda statunitense Eat Just è stato venduto. [16]
Mentre la maggior parte degli sforzi si concentra su carni comuni come maiale, manzo e pollo che costituiscono la maggior parte del consumo nei paesi sviluppati, aziende come Orbillion Bio si concentrano su carni di fascia alta o insolite tra cui alce, agnello, bisonte e manzo Wagyu. [18] Avant Meats ha introdotto sul mercato cernie coltivate nel 2021,[19] mentre altre aziende hanno perseguito diverse specie di pesce e altri frutti di mare. [20]
Il processo produttivo è in continua evoluzione, guidato da aziende ed enti di ricerca. [21] Le applicazioni per la carne coltivata hanno portato a discussioni etiche,[22] sanitarie, ambientali, culturali ed economiche. [23] I dati pubblicati dall'organizzazione non governativa Good Food Institute hanno rilevato che nel 2021 le aziende di carne coltivata hanno attirato 140 milioni di dollari in Europa. [3] La carne coltivata è prodotta in serie in Israele. [24] Il primo ristorante a servire carne coltivata è stato aperto a Singapore nel 2021. [25] La carne coltivata non è ancora ampiamente disponibile.
Nomenclatura
Oltre alla carne coltivata, per descrivere il prodotto sono stati utilizzati i termini carne sana,[26] carne senza macellazione,[27] carne in vitro,[28] carne coltivata in laboratorio,[29] carne a base cellulare,[30] carne pulita,[31] carne coltivata[32][33] e carne sintetica[34]. [35] Sebbene abbia più definizioni, la carne artificiale viene occasionalmente utilizzata. [36]
Tra il 2016 e il 2019, la carne pulita ha guadagnato terreno. Il Good Food Institute (GFI) ha coniato il termine nel 2016,[37] e alla fine del 2018 l'istituto ha pubblicato una ricerca in cui si affermava che l'uso di prodotti puliti rifletteva meglio il processo di produzione e i benefici. [38][39] Nel 2018 aveva superato colto e "in vitro" nelle menzioni dei media e nelle ricerche su Google. [40] Alcuni portatori di interessi del settore hanno ritenuto che il termine offuscasse inutilmente i produttori di carne convenzionali, continuando a preferire la carne a base cellulare come alternativa neutra. [41][42]
Nel settembre 2019, GFI ha annunciato una nuova ricerca che ha rilevato che il termine carne coltivata è sufficientemente descrittivo e differenziante, possiede un alto grado di neutralità e si colloca ai primi posti per l'attrattiva dei consumatori. [32][43] Un sondaggio del settembre 2021 ha indicato che la maggior parte degli amministratori delegati del settore ha una preferenza per la carne coltivata, con il 75% delle 44 aziende che la preferisce. [44]
Storia
Ricerca iniziale
La possibilità teorica di coltivare carne in un ambiente industriale è stata a lungo di interesse. In un saggio del 1931 pubblicato da vari periodici e in seguito incluso nella sua opera Thoughts and Adventures, lo statista britannico Winston Churchill scrisse: "Sfuggiremo all'assurdità di far crescere un pollo intero per mangiare il petto o l'ala, coltivando queste parti separatamente sotto un mezzo adatto". [45]
Negli anni '50, il ricercatore olandese Willem van Eelen ebbe in modo indipendente l'idea della carne coltivata. Come prigioniero di guerra durante la Seconda Guerra Mondiale, Van Eelen soffrì la fame, lasciandolo appassionato alla produzione alimentare e alla sicurezza alimentare. [46] Partecipò a una conferenza universitaria in cui si discuteva delle prospettive della carne conservata. [47] La precedente scoperta delle linee cellulari fornì la base per l'idea. La coltivazione in vitro delle fibre muscolari è stata eseguita per la prima volta con successo nel 1971, quando il patologo Russel Ross ha coltivato l'aorta di un porcellino d'India. Nel 1991, Jon F. Vein ottenne il brevetto US 6835390 per la produzione di carne ingegnerizzata per il consumo umano, in cui muscoli e grasso sarebbero stati coltivati in modo integrato per creare prodotti alimentari. [48]
Nel 2001, il dermatologo Wiete Westerhof, insieme a van Eelen e all'uomo d'affari Willem van Kooten, annunciò di aver depositato un brevetto mondiale su un processo per produrre carne coltivata. [49] Il processo impiegava una matrice di collagene seminata con cellule muscolari immerse in una soluzione nutriente e indotte a dividersi. Nello stesso anno, la NASA iniziò a condurre esperimenti di carne coltivata, con l'intento di consentire agli astronauti di coltivare carne invece di trasportarla. In collaborazione con Morris Benjaminson, hanno coltivato pesci rossi e tacchini. [51] Nel 2003, Oron Catts e Ionat Zurr hanno esposto alcuni centimetri di "bistecca", coltivata da cellule staminali di rana, che hanno cucinato e mangiato. L'obiettivo era quello di avviare una conversazione sull'etica della carne coltivata: "è mai stata viva?", "è mai stata uccisa?", "è in qualche modo irrispettoso nei confronti di un animale gettarla via?" [52]
All'inizio degli anni 2000, lo studente americano di salute pubblica Jason Matheny si è recato in India e ha visitato un allevamento di polli intensivi. Era inorridito dalle implicazioni di questo sistema. Matheny in seguito ha collaborato con tre scienziati coinvolti negli sforzi della NASA. Nel 2004, Matheny ha fondato New Harvest per incoraggiare lo sviluppo finanziando la ricerca. Nel 2005, i quattro hanno pubblicato la prima letteratura peer-reviewed sull'argomento. [53]
Nel maggio 2008, PETA ha offerto un premio di 1 milione di dollari alla prima azienda a portare carne di pollo coltivata ai consumatori entro il 2012. [54] Al concorrente è stato richiesto di completare due compiti per guadagnare il premio, vale a dire produrre un prodotto a base di carne di pollo coltivato che fosse indistinguibile dal vero pollo e produrre il prodotto in quantità abbastanza grandi da essere venduto in modo competitivo in almeno 10 stati. Il concorso è stato successivamente prorogato fino al 4 marzo 2014. Il termine alla fine è scaduto senza un vincitore. [55]
Il governo olandese ha investito 4 milioni di dollari in esperimenti riguardanti la carne coltivata. [56] L'In Vitro Meat Consortium, un gruppo formato da ricercatori internazionali, ha tenuto la prima conferenza internazionale ospitata dal Norwegian Food Research Institute nell'aprile 2008. [57] La rivista Time ha dichiarato che la produzione di carne coltivata è una delle 50 idee rivoluzionarie del 2009. [58] Nel novembre 2009, gli scienziati dei Paesi Bassi hanno annunciato di essere riusciti a coltivare carne utilizzando cellule di un maiale vivo. [59]
Primo processo pubblico
Il primo hamburger di manzo coltivato è stato creato da Mark Post all'Università di Maastricht nel 2013. [60] È stato realizzato con oltre 20.000 fili sottili di tessuto muscolare, è costato oltre $ 300.000 e ha richiesto 2 anni per essere prodotto. [61] L'hamburger è stato testato in diretta televisiva a Londra il 5 agosto 2013. È stato cucinato dallo chef Richard McGeown del Couch's Great House Restaurant, Polperro, in Cornovaglia, e assaggiato dai critici Hanni Rützler, ricercatore alimentare del Future Food Studio, e Josh Schonwald. Rützler ha dichiarato: "C'è davvero un morso, c'è un bel po' di sapore con la doratura. So che non c'è grasso, quindi non sapevo davvero quanto sarebbe stato succoso, ma c'è un gusto piuttosto intenso; È vicino alla carne, non è così succoso, ma la consistenza è perfetta. Questa è carne per me... È davvero qualcosa da mordere e penso che l'aspetto sia abbastanza simile". Rützler ha aggiunto che anche in uno studio alla cieca avrebbe preso il prodotto per la carne piuttosto che una copia di soia.
Sviluppo dell'industria
Hanni Rützler assaggia il primo hamburger coltivato al mondo, 5 agosto 2013.
È solo questione di tempo prima che questo accada, ne sono assolutamente convinto. Nel nostro caso, stimo che il tempo sia di circa 3 anni prima di essere pronti per entrare nel mercato su piccola scala, circa 5 anni per entrare nel mercato su scala più ampia, e se mi chiedete: "Quando [la carne coltivata] sarà nel supermercato dietro l'angolo?" Sarà più vicino a 10 che a 5 anni, credo.
Peter Verstrate, Carne di Mosa (2018)[63]: 1:06:15
Tra il 2011 e il 2017 sono state lanciate molte startup di carne coltivata. Memphis Meats, ora noto come Upside Foods, ha lanciato un video nel febbraio 2016, mostrando la sua polpetta di manzo coltivato. [65][66][67] Nel marzo 2017, ha messo in mostra offerte di pollo e anatra a l'orange, il primo pollame coltivato mostrato al pubblico. [68][69][70] Una società israeliana, SuperMeat, ha condotto una campagna di crowdfunding nel 2016, per il suo lavoro sul pollo coltivato. [71][72][73][74][75] Finless Foods, un'azienda con sede a San Francisco che lavora sul pesce allevato, è stata fondata nel giugno 2016. A marzo 2017 ha iniziato le operazioni di laboratorio. [76]
Nel marzo 2018, Eat Just (nel 2011 fondata come Hampton Creek a San Francisco, in seguito nota come Just, Inc.) ha affermato di essere in grado di offrire un prodotto di consumo a base di carne coltivata entro la fine del 2018. Secondo il CEO Josh Tetrick, la tecnologia era già presente. JUST aveva circa 130 dipendenti e un dipartimento di ricerca di 55 scienziati, dove si studiava la carne coltivata di pollame, maiale e manzo. JUST ha ricevuto investimenti dal miliardario cinese Li Ka-shing, dal co-fondatore di Yahoo! Jerry Yang e, secondo Tetrick, anche da Heineken International e altri. [77]
C'è una manciata [di startup]. È abbastanza interessante da vedere, ci sono tre hub: uno nella Silicon Valley, uno nei Paesi Bassi e uno in Israele. Penso che questo sia dovuto al fatto che questi tre posti hanno, in primo luogo, una grande università agraria: abbiamo Wageningen; in secondo luogo, una grande università di medicina – per noi è Leida; e infine abbiamo Delft dal punto di vista ingegneristico. Questi tre elementi combinati ti danno una solida base per [sviluppare carne coltivata], e questa [combinazione] esiste in Israele, nei Paesi Bassi e in America.
Krijn de Nood, Meatable (2020)[78]
La startup olandese Meatable, composta da Krijn de Nood, Daan Luining, Ruud Out, Roger Pederson, Mark Kotter e Gordana Apic tra gli altri, ha riferito nel settembre 2018 di essere riuscita a coltivare carne utilizzando cellule staminali pluripotenti provenienti da cordoni ombelicali animali. Sebbene tali cellule siano difficili da lavorare, Meatable ha affermato di essere in grado di indirizzarle a comportarsi in modo che diventino cellule muscolari o adipose secondo necessità. Il vantaggio principale è che questa tecnica bypassa il siero fetale bovino, il che significa che nessun animale deve essere ucciso per produrre carne. [79] Quel mese, circa 30 startup di carne coltivata operavano in tutto il mondo. [63] Integriculture è una società con sede in Giappone che lavora sul proprio sistema CulNet. Tra i concorrenti c'erano l'inglese Multus Media e la canadese Future Fields. [80]
Nell'agosto 2019, cinque startup americane hanno annunciato la formazione dell'Alliance for Meat, Poultry & Seafood Innovation (AMPS Innovation), una coalizione che cerca di lavorare con le autorità di regolamentazione per creare un percorso verso il mercato per la carne e i frutti di mare coltivati. I membri fondatori includono Eat Just, Memphis Meats, Finless Foods, BlueNalu e Fork & Goode. [82] Analogamente, nel dicembre 2021, un gruppo di 13 società europee e israeliane (Aleph Farms, Bluu Biosciences, Cubiq Foods, Future Meat, Gourmey, Higher Steaks, Ivy Farm, Meatable, Mirai Foods, Mosa Meat, Peace of Meat, SuperMeat e Vital Meat) ha istituito Cellular Agriculture Europe, un'associazione con sede in Belgio che ha cercato di "trovare un terreno comune e parlare con una voce condivisa per il bene del settore, consumatori e le autorità di regolamentazione». [83][84][85]
Nell'ottobre 2019, Aleph Farms ha collaborato con 3D Bioprinting Solutions per coltivare carne sulla Stazione Spaziale Internazionale. Questo è stato fatto estrudendo cellule di carne su un'impalcatura utilizzando una stampante 3D. [86] Nel gennaio 2020, Quartz ha trovato circa 30 startup di carne coltivata e che Memphis Meats, Just Inc. e Future Meat Technologies erano le più avanzate perché stavano costruendo impianti pilota. [87][88] Secondo New Scientist nel maggio 2020, 60 start-up stavano sviluppando carne coltivata. Alcuni di questi erano fornitori di tecnologia. Secondo quanto riferito, i mezzi di crescita costano ancora "centinaia di dollari al litro, ma per la produzione di carne pulita su larga scala questo deve scendere a circa $ 1 al litro". [89] Nel giugno 2020, i funzionari del governo cinese hanno chiesto una strategia nazionale per competere nella carne coltivata. [90]
Nel dicembre 2019, il progetto Foieture è stato lanciato in Belgio con l'obiettivo di sviluppare il foie gras coltivato (il nome è un portmanteau di "foie" e "futuro") da un consorzio di 3 aziende (la startup di carne coltivata Peace of Meat, la piccola azienda di condimento della carne Solina e la piccola azienda produttrice di paté Nauta) e 3 istituti senza scopo di lucro (università KU Leuven, centro di innovazione per l'industria alimentare Flanders Food e Bio Base Europe Pilot Plant). [91] Peace of Meat ha dichiarato nel dicembre 2019 che intendeva completare la sua prova di concetto nel 2020, produrre il suo primo prototipo nel 2022 e andare sul mercato nel 2023. [91] Quel mese, il progetto Foieture ha ricevuto una sovvenzione di ricerca di quasi 3,6 milioni di euro dall'Agenzia per l'innovazione e le imprese del governo fiammingo. [91] Nel maggio 2020, la cofondatrice e ricercatrice scientifica di origine austriaca di Peace of Meat, Eva Sommer, ha dichiarato che la startup è stata in grado di produrre 20 grammi di grasso coltivato al costo di circa 300 euro (15.000 euro/kg); L'obiettivo era quello di ridurre il prezzo a 6 euro al chilogrammo entro il 2030. [92] Piece of Meat costruì due laboratori nel porto di Anversa. [92] Alla fine del 2020, MeaTech ha acquisito Peace of Meat per 15 milioni di euro e ha annunciato nel maggio 2021 che avrebbe costruito un nuovo impianto pilota su larga scala ad Anversa entro il 2022. [93]
Nel novembre 2020, la start-up indiana Clear Meat ha affermato di essere riuscita a coltivare carne macinata di pollo al costo di sole 800-850 rupie indiane (10,77-11,44 dollari), mentre un pollo lavorato macellato costava circa 1.000 rupie. [94] Il 27 aprile 2022 la Commissione europea ha approvato la richiesta di raccolta di firme per l'iniziativa dei cittadini europei End The Slaughter Age volta a trasferire le sovvenzioni dalla zootecnia all'agricoltura cellulare. [95]
Ingresso nel mercato
Ingresso nell'Unione Europea
Nell'Unione europea, i nuovi alimenti come i prodotti a base di carne coltivata devono passare attraverso un periodo di test di circa 18 mesi durante il quale un'azienda deve dimostrare all'Autorità europea per la sicurezza alimentare (EFSA) che il loro prodotto è sicuro. [96][97] Nel marzo 2022, i produttori di carne coltivata avevano raggiunto il livello del tentativo di ottenere l'approvazione normativa da parte delle istituzioni sovranazionali dell'Unione europea, poco prima che i beni di massa potessero essere venduti ai consumatori. [3] A febbraio 2023, nessuno aveva ancora presentato un fascicolo di nuovi alimenti per l'approvazione da parte dell'EFSA. [97] Gli esperti legali hanno spiegato che ciò ha a che fare con il fatto che, sebbene la procedura dell'EFSA per i nuovi alimenti sia ben consolidata dal 1997 (a differenza di altre giurisdizioni, che hanno ancora o hanno dovuto sviluppare determinati standard normativi), si tratta di un processo lungo e complicato in cui le aziende possono avere poco contributo una volta presentata la loro richiesta, a differenza delle startup di carne coltivata negli Stati Uniti (che potrebbero facilmente comunicare avanti e indietro con la FDA per chiarire eventuali problemi) e nel Regno Unito, Singapore e Israele (dove i governi hanno implementato un "unico punto di contatto" responsabile dell'intero processo). [97]
Ingresso in Israele
Nel novembre 2020, SuperMeat ha aperto un ristorante di prova a Ness Ziona, in Israele, proprio accanto al suo impianto pilota; Giornalisti, esperti e un piccolo numero di consumatori hanno potuto prenotare un appuntamento per assaggiare il nuovo alimento, guardando attraverso una finestra di vetro nell'impianto di produzione dall'altra parte. Il ristorante non era ancora completamente aperto al pubblico, perché a giugno 2021 SuperMeat doveva ancora attendere l'approvazione normativa per avviare la produzione di massa per il consumo pubblico e perché la pandemia di COVID-19 ha limitato le operazioni del ristorante. [98][99] A febbraio 2023, le autorità israeliane avevano stabilito una struttura normativa simile a quella di Singapore e avevano mostrato una volontà generale di lavorare per l'approvazione (oltre a finanziare la ricerca per l'innovazione alimentare coltivata), ma erano ancora in fase di sviluppo di norme di sicurezza in consultazione con ricercatori e altri esperti. [97] Ad esempio, nel settembre 2022 il ministero della Salute israeliano e l'Organizzazione delle Nazioni Unite per l'alimentazione e l'agricoltura (FAO) hanno co-organizzato una convention di esperti in materia di regolamentazione della sicurezza alimentare coltivata. [97]
Nel gennaio 2024, il Ministero della Salute israeliano ha concesso l'approvazione normativa per la carne bovina coltivata. [100]
Ingresso a Singapore
Piatto di pasta con straccetti di carne di pollo coltivata di Good Meat, servito al pubblico in un ristorante di Singapore.
Il 2 dicembre 2020, la Singapore Food Agency ha approvato i "bocconcini di pollo" prodotti da Eat Just per la vendita commerciale. È stata la prima volta che un prodotto a base di carne coltivata ha superato la revisione della sicurezza (che ha richiesto 2 anni) di un regolatore alimentare ed è stato ampiamente considerato una pietra miliare per l'industria. I bocconcini di pollo erano programmati per l'introduzione nei ristoranti di Singapore. [101] Il ristorante "1880" è diventato il primo a servire carne coltivata ai clienti sabato 19 dicembre 2020. [102][103]
Nel gennaio 2023, la SFA ha anche concesso l'approvazione normativa per la produzione di carne coltivata con terreni privi di siero alla controllata di Eat Just GOOD Meat, che dal 2020 aveva introdotto il suo prodotto a base di pollo pulito in diversi altri ristoranti di Singapore, nonché in centri di vendita ambulante e servizi di consegna di cibo, e stava costruendo i bioreattori per il suo nuovo stabilimento a Singapore. Si diceva che questa prima approvazione al mondo fosse una pietra miliare nel rendere la produzione di carne coltivata più scalabile ed efficiente. [104]
Ingresso negli Stati Uniti
Nel novembre 2022, la Food and Drug Administration (FDA) ha completato la consultazione pre-commercializzazione di Upside Foods (ex Memphis Meats), concludendo che i suoi prodotti erano sicuri da mangiare, una novità assoluta per le aziende di carne coltivata negli Stati Uniti. [105] L'approvazione dell'agenzia finale, il Dipartimento dell'Agricoltura degli Stati Uniti (USDA), è stata ricevuta da Upside Foods e Good Meat, entrambi per il pollo coltivato, nel giugno 2023.
Aziende che lavorano sulla carne coltivata
Nota: le date in corsivo si riferiscono alle date previste per il raggiungimento in futuro; possono spostarsi.
Nome Fondate Area Fuoco Costi recenti Prova di concetto Impianto pilota Ingresso nel mercato
Fattorie di Aleph 2017[107] Israele Manzo Oltre $ 3.000 / kg (reclamo novembre 2019) Dicembre 2018[107] Febbraio 2022[109] Fine 2022 (richiesta di febbraio 2022)[109]
Le formiche innovano[senza fonte] 2020 Singapore Maiale
Carni di Appleton[110] 2016 Canada Manzo
Alimenti di Artemys[111] 2019 Stati Uniti Carne Autunno 2020[112]
Carni Avant 2018[113] Hong Kong Proteine del pesce Novembre 2019[114] 2022 (affermazione dell'agosto 2020)[113]
Balletic Foods[115][fonte migliore necessaria] Stati Uniti
Perché gli animali[116] 2018 Stati Uniti Cibo per animali domestici Maggio 2019[117] 2022 (richiesta di agosto 2021)[118]
Tecnologie Bene Meat 2020 Repubblica Ceca Cibo per animali domestici 7.11. 2023[119]
Biftek[120] 2018[121] Turchia Terreni di coltura
BioBQ[122] 2018 Stati Uniti Impalcatura 2022[123]
BlueNalu[citazione necessaria] 2018 Stati Uniti Frutti di mare Autunno 2019[124]
BioTech Foods
(acquisita da JBS[125]) 2017[96] Spagna Carne di maiale[96] 100 €/kg (richiesta di risarcimento del luglio 2019)[126] 2020[127] metà 2024 (richiesta di dicembre 2021)[125]
Cell Ag Tech[citazione necessaria] 2018 Canada Carne
Cell Farm Food Tech[citazione necessaria] 2018 Argentina Carne
CellX 2020[128] Cina Maiale 2021[129][130] (entro il 2025) con l'obiettivo di raggiungere la parità di costo con la carne suina di provenienza convenzionale[131]
Carne chiara[132] 2019[132] India Pollame[132] c. 825 rupie/pollo (richiesta di novembre 2020)[94] 2022 (reclamo del maggio 2019)[133]
Cubiq Foods[citazione necessaria] 2018 Spagna Grasso Settembre 2019[134]
Polo di innovazione alimentare coltivata[135] 2021[135] Svizzera Carne[135] 2022 (richiesta di settembre 2021)[135]
Mangia solo 2011 Stati Uniti Carne C. 50 €/pepita (richiesta di gennaio 2020)[136] Dicembre 2017[137] Costruzione (gennaio 2020)[87] Dicembre 2020: ristoranti[101]Entro gennaio 2023: centri di vendita ambulante e servizi di ristorazione[104]
Alimenti senza pinne 2016[138] Stati Uniti Tonno $ 7.000 / lb (reclamo febbraio 2018) Settembre 2017[139] Costruzione (ottobre 2021)[140] Maggio 2022 (ristoranti e servizi di ristorazione)[141]
Fork & Goode[citazione necessaria] 2018 Stati Uniti Carne
Alimenti Forsea 2021 Israele Frutti di mare Gennaio 2024[142]
Campi futuri[citazione necessaria] 2017 Canada Terreni di coltura
Tecnologie per la carne del futuro 2018 Israele Carne $ 10 / lb (obiettivo febbraio 2020 entro il 2022) 2019 Giugno 2021[144] 2022 (affermazione dell'ottobre 2019)[145]
Gaia Foods[citazione necessaria] 2019 Singapore Carni rosse
Gourmey[citazione necessaria] 2019 Francia Foie gras
Heuros[citazione necessaria] 2017 Australia Cibo per animali domestici
Bistecche più alte 2017 Regno Unito Maiale £'Migliaia'/kg (richiesta di luglio 2020)[146] Luglio 2020[147]
Fattorie di Hoxton 2020 Regno Unito Grasso
IntegriCulture, Inc. 2015 Giappone Foie gras ¥ 20.000 / kg (reclamo luglio 2019) 2021[149] 2021 (richiesta di risarcimento luglio 2020)
Matrix Meats[citazione necessaria] 2019 Stati Uniti Impalcatura 2020[150]
Carnibile 2018 Paesi Bassi Maiale Fine 2020[151] Preparazione (settembre 2021)[152][153] 2023 (richiesta di aprile 2021)[151]
Carileo 2021 Canada Manzo
MeaTech
(filiale: Peace of Meat) 2019 Israele
Belgio Foie gras 15.000 €/kg (richiesta di maggio 2020)[92] 4 marzo 2020[154] Costruzione; 2022 (richiesta di maggio 2021)[93] 2023 (affermazione di dicembre 2019)[91]
cantone di Mewery 2020 Repubblica Ceca Maiale Metà 2022 2025
Alimenti Mirai 2020 Svizzera Manzo "Utilitaria"/kg (dichiarazione del giugno 2020)[155] Giugno 2020[155]
Fienili per missioni 2018 Stati Uniti Maiale
Carne di Mosa /
Università di Maastricht 2015 Paesi Bassi Manzo € 60 / kg (obiettivo febbraio 2017 entro il 2020)[156]"88 volte più economico" (affermazione luglio 2020)[157]
Agosto 2013 (UM)[62] Installazione (maggio 2020)[157] 2022 (affermazione di febbraio 2020)[158]
Motivo FoodWorks 2019[159] Stati Uniti Manzo Fine 2020 (richiesta di agosto 2020)[160] Q4 2021 (aroma di manzo) (claim ottobre 2020)[161]
Multus Media[citazione necessaria] 2019 Regno Unito Terreni di coltura Ottobre 2019[162]
Carni New Age 2018[163] Stati Uniti Maiale Settembre 2018[164] Costruzione (ottobre 2021)[165] 2022[165]
Cibi primordiali[citazione necessaria] 2022 Regno Unito
Stati Uniti Carne selvatica
SavorEat 2016[107] Israele Manzo Metà 2021 (ristoranti) (claim maggio 2020)[107]
Carni Shiok 2018[166] Singapore Gamberetto $ 3,500 / kg (richiesta di ottobre 2020)[167] 2019[167] 2021 (rivendicazione marzo 2020)[168][166][169]
Shojinmeat Project[170][fonte migliore necessaria] Giappone
SuperCarne 2015[107] Israele Pollame $ 35 / hamburger (reclamo dicembre 2020)[98] 2018[171] Novembre 2020[99] Entro il 2022 (affermazione di maggio 2020)[107]Ristorante di prova novembre 2020[99]
Upside Foods
(precedentemente Memphis Meats) 2015 Stati Uniti Pollame $ 1,700 / lb (reclamo febbraio 2018) Febbraio 2016[173] 4 novembre 2021[174][175] Intorno al 2020 (affermazione del febbraio 2017)[156]
Giurare 2019[176] Australia Canguro 1350 USD/kg (richiesta di rimborso agosto 2019)[177] Agosto 2019[177] Ottobre 2022[178] 2022 (ristoranti) (Ottobre 2019 claim)[179]
Alimenti selvatici 2016 Stati Uniti Salmone Giugno 2019[180] 24 giugno 2021[181]
Oltre a queste aziende, organizzazioni senza scopo di lucro come New Harvest, il Good Food Institute, ProVeg International e la Cellular Agriculture Society sostengono, finanziano e ricercano la carne coltivata. [183]
Impianti pilota
Nota: i dati in corsivo si riferiscono a progetti incompiuti o a capacità previste in futuro; possono spostarsi.
Società Ubicazione In servizio Capacità
Fattorie di Aleph Rehovot, Israele[184] Febbraio 2022[109] (3.000 m. 2[184]). Pienamente operativo entro l'estate 2022[109]
BioTech Foods
(acquisita da JBS[125]) San Sebastián, Spagna[125] 2020[127]
Mangia solo San Francisco, California[140] Costruzione (gennaio 2020)[87] (20+ bioreattori da 1200L[140])
Singapore[104] Costruzione di un impianto (gennaio 2023)[104] Numero sconosciuto di bioreattori da 6000L[104]
Alimenti senza pinne Emeryville, California[140] Costruzione (ottobre 2021)[140]
Tecnologie per la carne del futuro Rehovot, Israele[184] Giugno 2021[144] 500 chilogrammi al giorno (182.625 kg / anno)
Meatable & DSM Delft, Paesi Bassi[153][152] Preparazione (settembre 2021)[153][152] 5.000 chilogrammi al giorno entro il 2025
MeaTech / Pace della Carne Anversa, Belgio[91] 2 laboratori marzo 2020[154] 700 grammi per ciclo di produzione[185]
Anversa, Belgio[93] Costruzione dell'impianto (maggio 2021)[93]
Carne di Mosa Maastricht, Paesi Bassi[186] Installazione (maggio 2020)[157] 100 chilogrammi al mese (1.200 kg/anno) per bioreattore da 200 litri[187][186](scalabile a 180.000 kg/anno)[186]
SuperCarne Ness Ziona, Israele[98][99] Novembre 2020[98][99] "Centinaia di chilogrammi" a settimana (giugno 2021)[99]
Upside Foods
(Carni di Memphis) Emeryville, California[174] 4 novembre 2021[174] 22.680 chilogrammi (50.000 libbre) all'anno[174][175](scalabile a 400.000 libbre/anno / 181.440 kg/anno)[175]
Alimenti selvatici San Francisco, California[140] 24 giugno 2021[181] 50.000 libbre (22.680 kg) di salmone all'anno[140](scalabile a 200.000 libbre/anno / 90.718 kg/anno)[140]
Processo
Linee cellulari
L'agricoltura cellulare richiede linee cellulari, generalmente cellule staminali. Le cellule staminali sono cellule indifferenziate che hanno il potenziale per diventare molti o tutti i tipi richiesti di tipi di cellule specializzate. Le cellule staminali totipotenti hanno la capacità di differenziarsi in tutti i diversi tipi di cellule presenti all'interno del corpo. Le cellule staminali pluripotenti possono maturare in tutti i tipi di cellule, tranne quelle della placenta, e le cellule staminali multipotenti possono differenziarsi in diversi tipi di cellule specializzate all'interno di un lignaggio. Le cellule staminali unipotenti possono differenziarsi in un destino cellulare specifico. [188]
Le cellule staminali possono differenziarsi in una serie di cellule specializzate.
Mentre le cellule staminali pluripotenti sarebbero una fonte ideale, l'esempio più importante di questa sottocategoria sono le cellule staminali embrionali che, a causa di questioni etiche, sono controverse per l'uso nella ricerca. Di conseguenza, gli scienziati hanno sviluppato cellule staminali pluripotenti indotte (iPSC), essenzialmente cellule del sangue e della pelle multipotenti che sono state regredite a uno stato pluripotente che consente loro di differenziarsi in una gamma più ampia di cellule. L'alternativa è l'utilizzo di cellule staminali adulte multipotenti che danno origine a linee di cellule muscolari o progenitori unipotenti che si differenziano in cellule muscolari. [188]
Le caratteristiche favorevoli delle cellule staminali includono l'immortalità, la capacità proliferativa, la mancanza di dipendenza dall'aderenza, l'indipendenza del siero e la facile differenziazione nei tessuti. È probabile che la presenza naturale di tali caratteristiche differisca a seconda della specie cellulare e dell'origine. Pertanto, la coltivazione in vitro deve essere adattata per soddisfare le esatte esigenze di una specifica linea cellulare. Il problema dell'immortalità è che le cellule hanno un limite al numero di volte in cui possono dividersi che è dettato dal loro telomere cap, basi nucleotidiche supplementari aggiunte all'estremità dei loro cromosomi. Ad ogni divisione, il cappuccio dei telomeri si accorcia progressivamente fino a quando non rimane nulla, momento in cui le cellule cessano di dividersi. La pluripotenza indotta può allungare il cappuccio dei telomeri in modo tale che le cellule si dividano indefinitamente. [189]
Le linee cellulari possono essere raccolte da una fonte primaria, cioè attraverso una biopsia su un animale in anestesia locale. Potrebbero anche essere stabiliti da fonti secondarie come le colture crioconservate (colture congelate dopo ricerche precedenti). [citazione necessaria]
Substrato di crescita
I mioblasti sono un precursore delle cellule muscolari e le loro fibre sono mostrate in giallo e i nuclei mostrati in blu.
Una volta che le linee cellulari sono stabilite, vengono immerse in un terreno di coltura per indurle a proliferare. I terreni di coltura sono in genere formulati a partire da terreni basali che forniscono alle cellule i carboidrati, i grassi, le proteine e i sali necessari. Una volta che una cellula ne consuma una quantità sufficiente, si divide e la popolazione aumenta in modo esponenziale. I terreni di coltura possono essere integrati con additivi, ad esempio sieri, che forniscono ulteriori fattori di crescita. I fattori di crescita possono essere proteine secrete o steroidi che sono cruciali nella regolazione dei processi cellulari. [2]
Una volta iniziata la differenziazione, le fibre muscolari iniziano a contrarsi e a generare acido lattico. La capacità delle cellule di assorbire i nutrienti e proliferare dipende in parte dal pH del loro ambiente. Man mano che l'acido lattico si accumula all'interno del mezzo, l'ambiente diventerà progressivamente più acido e scenderà al di sotto del pH ottimale. Di conseguenza, i terreni di coltura devono essere aggiornati frequentemente. Questo aiuta a rinfrescare la concentrazione di sostanze nutritive dal terreno basale. [21]
Impalcatura
Il tessuto muscolare viene sviluppato dal mezzo di crescita e organizzato in una struttura tridimensionale dall'impalcatura per il prodotto finale.
Nel caso di prodotti a base di carne strutturati, prodotti che sono caratterizzati dalla loro configurazione generale e dal tipo di cellula, le cellule devono essere seminate su scaffold. Gli scaffold sono essenzialmente stampi destinati a riflettere e incoraggiare le cellule a organizzarsi in una struttura più grande. Quando le cellule si sviluppano in vivo, sono influenzate dalle loro interazioni con la matrice extracellulare (ECM). L'ECM è la rete tridimensionale di glicoproteine, collagene ed enzimi responsabili della trasmissione di segnali meccanici e biochimici alla cellula. Gli scaffold devono simulare le caratteristiche dell'ECM. [2]
Porosità
I pori sono minuscole aperture sulla superficie dell'impalcatura. Possono essere creati sulla superficie del biomateriale al fine di rilasciare componenti cellulari che potrebbero interferire con lo sviluppo dei tessuti. Aiutano anche a diffondere gas e sostanze nutritive negli strati più interni delle cellule aderenti, impedendo la formazione di un "centro necrotico". Un centro necrotico è un fenomeno in cui le cellule che non sono a diretto contatto con il terreno di coltura muoiono per mancanza di nutrienti. [190]
Vascolarizzazione
Il tessuto vascolare presente nelle piante contiene gli organi responsabili del trasporto interno dei fluidi. Forma topografie naturali che forniscono un modo a basso costo per promuovere l'allineamento cellulare replicando lo stato fisiologico naturale dei mioblasti. Può anche aiutare con lo scambio di gas e nutrienti. [190]
Proprietà biochimiche
Le proprietà biochimiche di uno scaffold dovrebbero essere simili a quelle dell'ECM. Deve facilitare l'adesione cellulare attraverso le qualità tessiturali o il legame chimico. Inoltre, deve produrre i segnali chimici che incoraggiano la differenziazione cellulare. In alternativa, il materiale dovrebbe essere in grado di miscelarsi con altre sostanze che hanno queste qualità funzionali. [190]
Cristallinità
Il grado di cristallinità di un materiale determina qualità come la rigidità. L'elevata cristallinità può essere attribuita al legame idrogeno che a sua volta aumenta la stabilità termica, la resistenza alla trazione (importante per mantenere la forma dell'impalcatura), la ritenzione idrica (importante per idratare le cellule) e il modulo di Young. [190]
Degrado
Alcuni materiali si degradano in composti benefici per le cellule, sebbene questa degradazione possa anche essere irrilevante o dannosa. La degradazione consente una facile rimozione dell'impalcatura dal prodotto finito, lasciando solo il tessuto animale, aumentando così la sua somiglianza con la carne in vivo. Questa degradazione può essere indotta dall'esposizione a determinati enzimi che non hanno alcun impatto sul tessuto muscolare. [190]
Commestibilità
Se le impalcature non possono essere rimosse dal tessuto animale, devono essere commestibili per garantire la sicurezza dei consumatori. Sarebbe utile se fossero fatti con ingredienti nutrienti. [190] Dal 2010, sono emersi gruppi di ricerca accademici e aziende al fine di identificare le materie prime che hanno le caratteristiche di impalcature idonee. [190][191][192][193][194][195]
Cellulosa
La cellulosa è il polimero più abbondante in natura e fornisce l'esoscheletro delle foglie delle piante. Grazie alla sua abbondanza, può essere ottenuto a un costo relativamente basso. È anche versatile e biocompatibile. Attraverso un processo chiamato "decellularizzazione", viene rivestito da un tensioattivo che crea pori. Questi pori rilasciano i componenti cellulari della pianta che diventa tessuto vegetale decellularizzato. Questo materiale è stato ampiamente studiato dai gruppi Pelling e Gaudette rispettivamente dell'Università di Ottawa e del Worcester Polytechnic Institute. Attraverso la reticolazione (formazione di legami covalenti tra le singole catene polimeriche per tenerle insieme) le proprietà meccaniche del tessuto vegetale possono essere modificate in modo che assomigli più da vicino al tessuto muscolare. Questo può essere fatto anche mescolando il tessuto vegetale con altri materiali. D'altra parte, il tessuto vegetale decellularizzato in genere manca di segnali biochimici dei mammiferi, quindi deve essere rivestito con proteine funzionali compensatorie. Non è stato dimostrato che la crescita di C2C12 cambi significativamente tra l'impalcatura nuda e la stessa impalcatura con un rivestimento di proteine di collagene o gelatina; Tuttavia, l'efficienza di semina (velocità con cui le cellule si attaccano all'impalcatura) è migliorata. [190][191]
Un vantaggio del tessuto vegetale decellularizzato è la topografia naturale offerta dalla vascolarizzazione fogliare. Questo aiuta a replicare lo stato fisiologico naturale dei mioblasti che promuove l'allineamento cellulare. Gli altri modi per farlo sono di solito un po' più costosi, tra cui la stampa 3D, la litografia morbida e la fotolitografia. La vascolarizzazione può anche aiutare a superare il limite di diffusione di 100-200 nm del terreno di coltura nelle cellule che di solito producono centri necrotici nei conglomerati muscolari. Un altro modo per farlo è avere un'impalcatura porosa che supporti l'angiogenesi (lo sviluppo di nuovi vasi sanguigni). Sebbene sia stato dimostrato che questo funziona per l'Hypanthium della mela, non tutte le piante sono così porose. L'alternativa alla cellulosa vegetale è la cellulosa batterica, che è in genere più pura della cellulosa vegetale in quanto priva di contaminanti come lignina ed emicellulosa. La cellulosa batterica ha più legami idrogeno tra i suoi filamenti polimerici e quindi ha una maggiore cristallinità. Ha anche microfibrille più piccole che gli consentono di trattenere più umidità e avere pori più piccoli. La sostanza può essere prodotta utilizzando carboidrati di scarto (il che può consentire di produrla in modo meno costoso) e aggiunge succosità e masticabilità alla carne emulsionata (il che significherebbe che anche se non può essere estratta dal prodotto finale, contribuirà al profilo di consistenza). [190][191]
Chitina
La chitina è il secondo polimero più abbondante in natura. Si trova negli esoscheletri di crostacei e funghi. Poiché l'agricoltura cellulare sta tentando di porre fine alla dipendenza dagli animali, la chitina derivata dai funghi è di maggiore interesse. È stato studiato principalmente dal Pelling Group. Il chitosano è derivato dalla chitina in un processo noto come deacetilazione alcalina (sostituzione di alcuni gruppi di amminoacidi). Il grado di questo processo determina le proprietà fisiche e chimiche del chitosano. Il chitosano ha proprietà antibatteriche; in particolare, ha effetti battericidi sui batteri planctonici e sui biofilm e un effetto statico sui batteri gram-negativi come E. coli. Questo è importante in quanto neutralizza i composti potenzialmente dannosi senza l'uso di antibiotici, che molti consumatori evitano. La somiglianza del chitosano con i glicosaminoglicani e le interazioni interne tra glicoproteine e proteoglicani lo rendono altamente biocompatibile. Può facilmente miscelarsi con altri polimeri per selezionare più fattori bioattivi. Un potenziale svantaggio del chitosano è che si degrada in presenza di lisozimi (enzimi presenti in natura). Ma questo può essere resistito usando la deacetilazione. Questo non è del tutto negativo, poiché i sottoprodotti prodotti attraverso la degradazione hanno proprietà antinfiammatorie e antibatteriche. È importante far corrispondere il livello in cui le cellule si affidano alla matrice per la struttura con la degradazione. [190]
Collagene
Il collagene è una famiglia di proteine che costituisce la struttura primaria del tessuto connettivo umano. È tipicamente derivato da fonti bovine, suine e murine. L'agricoltura cellulare supera questa dipendenza attraverso l'uso di organismi transgenici che sono in grado di produrre le ripetizioni aminoacidiche che compongono il collagene. Il collagene esiste naturalmente come collagene di tipo I. È stato prodotto sotto forma di idrogel porosi, compositi e substrati con indicazioni topografiche e proprietà biochimiche. Tipi sintetici di collagene sono stati prodotti attraverso la produzione di proteine ricombinanti: collagene di tipo II e III, tropoelastina e fibronectina. Una sfida con queste proteine è che non possono essere modificate dopo la traduzione. Tuttavia, una proteina fibrillare alternativa è stata isolata in microbi che mancano dei segnali biochimici del collagene, ma ha il suo tipo di personalizzazione genica. Uno degli obiettivi della produzione di collagene ricombinante è l'ottimizzazione della resa, ovvero il modo in cui può essere prodotto nel modo più efficace. Le piante, in particolare il tabacco, sembrano l'opzione migliore, tuttavia, anche batteri e lieviti sono valide alternative. [190]
La proteina di soia testurizzata è un prodotto a base di farina di soia spesso utilizzato nella carne a base vegetale che supporta la crescita delle cellule bovine. La sua consistenza spugnosa consente un'efficiente semina cellulare e la sua porosità favorisce il trasferimento di ossigeno. Inoltre, si degrada durante la differenziazione cellulare in composti che sono benefici per alcune cellule. [192]
Micelio
Il micelio è la radice dei funghi. Altast Foods Co. utilizza la fermentazione allo stato solido per far crescere il tessuto dei funghi su impalcature di micelio. Raccolgono questo tessuto e lo usano per creare analoghi della pancetta. [193]
Nanomateriali
I nanomateriali presentano proprietà uniche su scala nanometrica. Biomimetic Solutions, con sede a Londra, sta sfruttando i nanomateriali per creare scaffold. [192] Cass Materials a Perth, in Australia, sta utilizzando una fibra alimentare chiamata Nata de Coco (derivata dalle noci di cocco) per creare spugne di nanocellulosa per la loro impalcatura BNC. Nata de Coco è biocompatibile, ha un'elevata porosità, facilita l'adesione cellulare ed è biodegradabile. [194]
Spinning
L'immersione Jet Spinning è un metodo per creare scaffold filando i polimeri in fibre. È stato sviluppato dal Parker Group di Harvard. La loro piattaforma utilizza la forza centrifuga per estrudere una soluzione polimerica attraverso un'apertura in un serbatoio rotante. Durante l'estrusione, la soluzione forma un getto che si allunga e si allinea mentre attraversa il traferro. Il getto viene diretto in un bagno di precipitazione controllato a vortice che lega chimicamente o precipita le nanofibre polimeriche. La regolazione del traferro, della rotazione e della soluzione modifica il diametro delle fibre risultanti. Questo metodo può far girare le impalcature da fogli di PPTA, nylon, DNA e nanofibre. Un'impalcatura nanofibrosa a base di alginato e gelatina è stata in grado di supportare la crescita delle cellule C2C12. I mioblasti della muscolatura liscia aortica di coniglio e bovino sono stati in grado di aderire alle fibre di gelatina. Hanno formato aggregati su fibre più corte e tessuto allineato su quelle più lunghe. Matrix Meats utilizza l'elettrofilatura, un processo che utilizza la forza elettrica per trasformare i polimeri carichi in fibre per impalcature. I loro scaffold consentono la marmorizzazione della carne, sono compatibili con più linee cellulari e sono scalabili. [196]
Produzione additiva
Il bioprinting che assembla le fibre cellulari potrebbe essere utilizzato per produrre una varietà di carne coltivata simile a una bistecca. [197]
Un altro modo proposto per strutturare il tessuto muscolare è la produzione additiva. Tale tecnica è stata perfezionata per applicazioni industriali nella produzione di oggetti in plastica, metallo, vetro e altri materiali sintetici. La variante più comune del processo prevede il deposito incrementale di un filamento a strati su un letto fino a quando l'oggetto non è completato. Questo metodo molto probabilmente si presterà meglio all'applicazione di carne coltivata rispetto ad altri tipi come il getto di legante, il getto di materiale o la stereolitografia che richiedono un tipo specifico di resina o polvere. [citazione necessaria]
Un filamento di cellule muscolari può essere stampato in una struttura destinata ad assomigliare a un prodotto finito a base di carne che può quindi essere ulteriormente lavorato per la maturazione cellulare. Questa tecnica è stata dimostrata in una collaborazione tra le soluzioni di bioprinting 3D e Aleph Farms che ha utilizzato la produzione additiva per strutturare le cellule di tacchino sulla Stazione Spaziale Internazionale. La biostampa 3D è stata utilizzata per produrre carne coltivata simile a una bistecca, composta da tre tipi di fibre cellulari bovine e con una struttura assemblata di fibre cellulari simile alla carne originale. [197][199]
Bioreattori
Potenziale configurazione del bioreattore per la carne coltivata
Gli scaffold sono posizionati all'interno dei bioreattori in modo che possa avvenire la crescita e la specializzazione cellulare. I bioreattori sono grandi macchine simili ai serbatoi di un birrificio che espongono le cellule a una grande varietà di fattori ambientali necessari per promuovere la proliferazione o la differenziazione. La temperatura del bioreattore deve replicarsi in condizioni in vivo. Nel caso delle cellule di mammifero, ciò richiede il riscaldamento a 37 °C (99 °F). In alternativa, le cellule degli insetti possono essere coltivate a temperatura ambiente. La maggior parte dei bioreattori sono mantenuti al 5% di anidride carbonica. [2][200] Le cellule possono essere coltivate in sistemi continui o in batch. Il primo comporta l'inoculazione e la raccolta di cellule in un processo costante in modo che ci siano sempre cellule nel bioreattore. I sistemi Fed-batch significano inoculare le cellule, coltivarle e raccoglierle in un unico periodo. [2]
I bioreattori a serbatoio agitato sono la configurazione più utilizzata. Una girante aumenta il flusso, omogeneizzando così i terreni di coltura e un diffusore facilita lo scambio di ossigeno nei terreni. Questo sistema viene generalmente utilizzato per le colture in sospensione, ma può essere utilizzato per le cellule che richiedono l'attaccamento a un'altra superficie se sono inclusi microcarrier. I bioreattori a letto fisso sono comunemente usati per le colture aderenti. Sono caratterizzati da strisce di fibre che sono impacchettate insieme per formare un letto a cui le cellule possono attaccarsi. I terreni di coltura aerati vengono fatti circolare attraverso il letto. Nei bioreattori ad aria, i terreni di coltura vengono aerati in forma gassosa utilizzando bolle d'aria che vengono poi disperse e disperse tra le cellule. I bioreattori a perfusione sono configurazioni comuni per la coltivazione continua. Drenano continuamente i terreni saturi di acido lattico che sono privi di sostanze nutritive e li riempiono con mezzi reintegrati.
Fattori di crescita
I terreni di coltura sono una componente essenziale della coltivazione in vitro. È responsabile della fornitura delle macromolecole, dei nutrienti e dei fattori di crescita necessari per la proliferazione cellulare. L'approvvigionamento dei fattori di crescita è uno dei compiti più impegnativi dell'agricoltura cellulare. Tradizionalmente, prevede l'uso di siero fetale bovino (FBS) che è un prodotto del sangue estratto da mucche fetali. Oltre all'argomentazione che la sua produzione non è etica, viola anche l'idea che la carne coltivata sia prodotta indipendentemente dall'uso di animali. È anche il costituente più costoso della carne coltivata, con un prezzo di circa $ 1000 al litro. Inoltre, la composizione chimica varia notevolmente a seconda dell'animale, quindi non può essere quantificata chimicamente in modo uniforme. [202] FBS è impiegato perché imita convenientemente il processo di sviluppo muscolare in vivo. I fattori di crescita necessari per lo sviluppo dei tessuti sono forniti principalmente attraverso il flusso sanguigno di un animale e nessun altro fluido conosciuto può fornire da solo tutti questi componenti. [2]
L'alternativa attuale è quella di generare ogni fattore di crescita individualmente utilizzando la produzione di proteine ricombinanti. In questo processo, i geni che codificano per il fattore specifico vengono integrati nei batteri che vengono poi fermentati. A causa della maggiore complessità di questo processo, è particolarmente costoso. [2] Future Fields, un'azienda canadese focalizzata sul superamento dei costi economici e ambientali dei substrati di crescita tradizionali, sta sviluppando fattori di crescita privi di siero dai moscerini della frutta. [203]
Il mezzo ideale sarebbe chimicamente quantificabile e accessibile per garantire semplicità nella produzione, economico e non dipendente dagli animali. [50] Molto probabilmente deriverà dalle piante e, sebbene ciò possa ridurre la possibilità di trasmettere agenti infettivi, può indurre reazioni allergiche in alcuni consumatori. [204] Tali sieri di coltura possono anche richiedere modifiche specifiche per la linea cellulare a cui sono applicati. Tra le aziende che attualmente investono nello sviluppo di un'efficace coltura a base vegetale ci sono Multus Media e Biftek. [205][206]
Il Good Food Institute (GFI) ha pubblicato un rapporto nel 2019 a sostegno del concetto che la carne a base cellulare potrebbe essere prodotta allo stesso costo della carne macinata e nel 2021 ha commissionato un rapporto a CE Delft sull'analisi tecnico-economica della carne coltivata. Un altro approccio è quello di sottoporre le linee cellulari a un campo magnetico, che stimola il rilascio di molecole che hanno proprietà rigenerative, metaboliche, antinfiammatorie e di potenziamento dell'immunità, eliminando la necessità di siero. [208]
Superficie
Una sfida comune per i bioreattori e gli scaffold è lo sviluppo di configurazioni di sistema che consentano a tutte le cellule di ottenere l'esposizione ai terreni di coltura, ottimizzando contemporaneamente i requisiti spaziali. Nella fase di proliferazione cellulare, prima dell'introduzione dello scaffold, molti tipi di cellule devono essere attaccati a una superficie per sostenere la crescita. Pertanto, le cellule devono essere coltivate in monostrati confluenti di una sola cella spessa, il che richiede molta superficie. Ciò pone sfide pratiche su larga scala. Pertanto, i sistemi possono incorporare microcarrier, piccole perle sferiche di vetro o altro materiale compatibile che sono sospese nel terreno di coltura. Le cellule aderiscono a questi microvettori come farebbero ai lati del bioreattore, il che aumenta la quantità di superficie. [209]
Nella fase di differenziamento cellulare, le cellule possono essere seminate su uno scaffold e quindi non richiedono l'uso di microcarrier. Tuttavia, in questi casi, la densità delle cellule sull'impalcatura significa che non tutte le cellule hanno un'interfaccia con i terreni di coltura, portando alla morte cellulare e ai centri necrotici all'interno della carne. Quando il muscolo viene coltivato in vivo, questo problema viene aggirato poiché la matrice extracellulare fornisce sostanze nutritive al muscolo attraverso i vasi sanguigni. Per questo motivo, molti scaffold emergenti mirano a replicare tali reti. [209]
Allo stesso modo, gli scaffold devono simulare molte delle altre caratteristiche della matrice extracellulare, in particolare la porosità, la cristallinità, la degradazione, la biocompatibilità e la funzionalità. Sono stati identificati pochi materiali che emulano tutte queste caratteristiche, portando alla possibilità di miscelare materiali diversi con proprietà complementari. [190]
Supporto alla ricerca
La ricerca sull'agricoltura cellulare non ha una base significativa di interesse accademico o flussi di finanziamento. [23] Di conseguenza, la maggior parte della ricerca è stata intrapresa e finanziata da istituzioni indipendenti. Questo sta cambiando in modo incrementale, poiché le organizzazioni non profit guidano il sostegno e l'interesse. In particolare, New Harvest ha un programma di borse di studio per sostenere studenti laureati e gruppi di varie istituzioni accademiche. Inoltre, un numero crescente di governi sta finanziando la ricerca nell'agricoltura cellulare. Nell'agosto 2020, i servizi di gestione delle sovvenzioni della Commissione europea hanno assegnato una sovvenzione di 2,5 milioni di euro a ORF Genetics. Nello stesso mese, il Ministero giapponese dell'Economia, del Commercio e dell'Industria ha concesso a Integriculture 2,2 milioni di dollari attraverso la loro New Energy and Industrial Technology Development Organization. [212]
Il quadro di finanziamento per la ricerca e lo sviluppo Horizon 2020 dell'Unione europea ha assegnato una sovvenzione di 2,7 milioni di euro a un consorzio guidato da BioTech Foods. Nel 2021, il governo spagnolo ha concesso 3,7 milioni di euro a Biotech Foods per studiare i potenziali benefici per la salute dell'agricoltura cellulare. La National Science Foundation ha assegnato una sovvenzione di 3,55 milioni di dollari a un team di ricercatori della UC Davis per la ricerca sulla carne coltivata ad accesso aperto. [215] Anche le organizzazioni non profit guidano il sostegno e l'interesse nel settore. In particolare, New Harvest ha un programma di borse di studio per sostenere la ricerca di specifici studenti laureati e gruppi presso varie istituzioni accademiche e il Good Food Institute finanzia la ricerca ad accesso aperto attraverso il suo programma di sovvenzioni per la ricerca. [citazione necessaria]
Accettazione da parte dei consumatori
L'accettazione del prodotto da parte dei consumatori è fondamentale. Uno studio che esamina l'accettazione della carne coltivata in Cina, India e Stati Uniti "ha trovato alti livelli di accettazione della carne pulita nei tre paesi più popolosi del mondo". [218] Sono stati individuati diversi potenziali fattori di accettazione della carne coltivata da parte dei consumatori. Salubrità, sicurezza, caratteristiche nutrizionali, sostenibilità, gusto e prezzo più basso sono tutti fattori che contribuiscono. Uno studio ha rilevato che l'uso di un linguaggio altamente tecnico per spiegare la carne coltivata ha portato a un atteggiamento pubblico significativamente più negativo nei confronti del concetto. [220] È importante comunicare in modo trasparente la scienza, ma condividere eccessivamente gli aspetti sbagliati del prodotto potrebbe attirare un'attenzione sfavorevole sui problemi di sicurezza. [221] Così, una delle sfide nel modo in cui la carne coltivata viene commercializzata è trovare l'equilibrio tra la trasparenza della scienza che c'è dietro, ma comunicarla in un modo che non susciti resistenza. Uno studio ha suggerito che descrivere la carne coltivata in un modo che enfatizza il prodotto finale piuttosto che il metodo di produzione era un modo efficace per migliorare l'accettazione. [223] Anche il ruolo della nomenclatura è cruciale. Sebbene la rappresentazione della "carne coltivata in laboratorio" della carne coltivata sia favorita dai media, è stata osteggiata dai leader del settore in quanto semina un'immagine innaturale della carne coltivata nelle percezioni dei consumatori. [224]
L'uso di descrizioni standardizzate migliorerebbe la ricerca futura sull'accettazione della carne coltivata da parte dei consumatori. Gli studi attuali hanno spesso riportato tassi di accettazione drasticamente diversi, nonostante popolazioni di indagine simili. Lou Cooperhouse, CEO di BlueNalu, ha condiviso sul Red to Green Podcast che "a base di cellule" e "cell-cultured" erano termini adatti per differenziarla dalla carne convenzionale, pur essendo chiaro sul processo con cui è stata prodotta. [226] Esiste anche una sfida su come utilizzare queste descrizioni nell'etichettatura. Ad esempio, negli Stati Uniti non esiste una legislazione federale generale che regoli il modo in cui la carne coltivata dovrebbe essere etichettata per il consumatore. Mentre i produttori di carne tradizionali stanno tentando di impedire alle aziende di carne coltivata di utilizzare il termine "carne", i produttori di carne coltivata sostengono che la parola è necessaria per l'accettazione da parte dei consumatori. [227]
L'accettazione del mercato globale non è stata valutata. Gli studi stanno tentando di determinare gli attuali livelli di accettazione da parte dei consumatori e di identificare metodi per migliorare questo valore. Non sono disponibili risposte chiare, anche se uno studio recente ha riportato che i consumatori erano disposti a pagare un sovrapprezzo per la carne coltivata. [219][220][223][228][229][230][231] Basse percentuali di popolazioni adulte più anziane sono state segnalate per mostrare l'accettazione per la carne coltivata. Il comportamento alimentare verde, lo stato educativo e il business alimentare sono stati citati come i fattori più importanti per questa popolazione. [230] Mancano anche studi che mettano in relazione i metodi di produzione della carne coltivata con il suo gusto per il pubblico dei consumatori. [citazione necessaria]
Regolamenti
Nel 2020, Singapore è diventato il primo paese al mondo ad approvare la vendita di carne coltivata. L'Agenzia per l'alimentazione di Singapore ha pubblicato una guida sui requisiti per la valutazione della sicurezza dei nuovi alimenti, compresi i requisiti specifici sulle informazioni da presentare per l'approvazione dei prodotti a base di carne coltivata. [232]
Nel marzo 2023, il governo italiano Meloni ha approvato un progetto di legge che vieta la produzione e la commercializzazione di carne coltivata per il consumo umano e animale; [233][234][235] Questa mossa, che il governo ha detto che aveva lo scopo di proteggere il patrimonio alimentare,[236] è stata criticata, anche dagli scienziati, per essere in contrasto con le tendenze globali di apertura e legalizzazione,[237] come fuorviante,[238] e per il possibile peggioramento del cambiamento climatico in Italia. [239] Nell'ottobre 2023, è stato riferito che il governo italiano aveva ritirato il progetto di legge,[240][241][242] e ritirato la notifica del sistema informativo del regolamento tecnico, una procedura volta a prevenire la creazione di barriere all'interno del mercato interno dell'Unione europea, per il disegno di legge. Francesco Lollobrigida, ministro dell'Agricoltura italiano, ha affermato che il ritiro della proposta di legge anti-carne coltivata che l'Italia ha presentato all'Unione europea "non è un passo indietro", che molti hanno ipotizzato fosse dovuto al fatto che il governo voleva evitare un probabile rifiuto da parte della Commissione europea. Ha aggiunto che il disegno di legge non sarebbe stato ritirato e sarebbe andato avanti. L'Italia è diventata il primo paese a vietare la carne coltivata nel novembre 2023, quando il governo ha approvato il disegno di legge. [245][246]
Anche le questioni normative devono essere risolte. Prima di essere disponibili per la vendita, l'Unione Europea, l'Australia, la Nuova Zelanda, il Regno Unito e il Canada richiedono l'approvazione di nuove applicazioni alimentari. Inoltre, a partire dal 1° gennaio 2018, l'Unione Europea richiede che i prodotti e la produzione di animali coltivati debbano dimostrare la sicurezza, con una domanda aziendale approvata. Nel settembre 2020, la Food and Drug Administration (FDA) e il Dipartimento dell'Agricoltura degli Stati Uniti (USDA) hanno concordato di regolamentare congiuntamente la carne coltivata. In base all'accordo, la FDA supervisiona la raccolta cellulare, le banche cellulari e la crescita e la differenziazione cellulare, mentre l'USDA supervisiona la produzione e l'etichettatura dei prodotti alimentari derivati dalle cellule destinate al consumo umano. Diversi stati degli Stati Uniti, come il Missouri, la Carolina del Sud, il Texas e Washington, hanno approvato una legislazione che limita l'uso del termine carne sulle confezioni di carne coltivata.
Differenze rispetto alla carne convenzionale
Salute
La produzione su larga scala di carne coltivata può richiedere o meno l'aggiunta di ormoni della crescita artificiali alla coltura per la produzione di carne. Poiché la carne coltivata viene coltivata in un ambiente sterile, non c'è bisogno di antibiotici. Oggi, l'uso diffuso di antibiotici nell'agricoltura convenzionale è il principale motore della resistenza agli antibiotici negli esseri umani. Secondo l'Organizzazione Mondiale della Sanità, la resistenza antimicrobica rappresenta "una minaccia sempre più grave per la salute pubblica globale che richiede un'azione in tutti i settori governativi e nella società", prevedendo fino a 10 milioni di morti all'anno entro il 2050. La carne coltivata potrebbe fornire una soluzione efficace per contribuire a mitigare questo grave rischio per la salute umana.
A causa dell'ambiente strettamente controllato e prevedibile, la produzione di carne coltivata è stata paragonata all'agricoltura
-
 22:40
22:40
MERDALIA💩LA REPUBBLICA DELLE BANANE E DEGLI IDIOTI
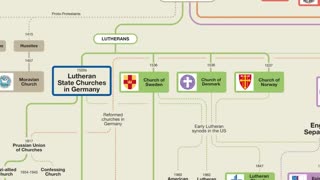
1 month agoStoria delle denominazioni del cristianesimo:chiese anglicane,luterane e riformate DOCUMENTARIO le denominazioni cristiane esistono da secoli come spiega lo schema stessa cosa nelle altre religioni
105 -
 2:42:30
2:42:30
TimcastIRL
8 hours agoKash Patel CONFIRMED, Deep State PANICS, Mitch McConnell To RETIRE w/ Kevin Smith | Timcast IRL
155K293 -
 1:04:47
1:04:47
Candace Show Podcast
12 hours agoBecoming Brigitte: The Epilogue
108K142 -
 3:43:51
3:43:51
Alex Zedra
7 hours agoLIVE! Come Play WoT with me!
38.4K11 -
 5:22:49
5:22:49
Drew Hernandez
15 hours agoDOGE EXPOSES $2 BILLION SCHEME LINKED TO STACEY ABRAMS?!
65.4K45 -
 1:27:59
1:27:59
Kim Iversen
11 hours agoRFK Jr Declares No More Cheetos on Welfare? | Yale Confirms Long Covid Is Actually Vaccine Injury!
92.2K110 -
 1:08:43
1:08:43
The Charlie Kirk Show
8 hours agoTHOUGHTCRIME Ep. 74 — Charlie's Campus Return? Robo-Butlers? Garden of American Heroes?
81K18 -
 1:09:53
1:09:53
Slightly Offensive
8 hours ago $6.68 earnedIs the US Headed for MORE WAR Under TRUMP? | Guest: Scott Horton
46.7K11 -
 58:29
58:29
The StoneZONE with Roger Stone
8 hours agoRoger Stone Hails Confirmation of Kash Patel, Trashes Schiff for Attacks On Patel | The StoneZONE
53.4K20 -
 48:44
48:44
Man in America
13 hours agoA MASSIVE Global Financial Reset Is Coming—Are You Ready?
41.6K21